婦人科
進行子宮頸癌を対象とした、腫瘍浸潤リンパ球輸注療法(TIL療法)の先進医療実施について
慶應義塾大学医学部産婦人科学教室では、「子宮頸癌を対象とした腫瘍浸潤リンパ球療法(TIL療法)」を実施しております。この治療は慶應義塾特定認定再生医療等委員会により第3種再生医療として適と判定され、加えて、厚生労働省先進医療会議において先進医療として許可されたものです。
進行・再発子宮頸癌は、極めて難治で、有効な薬剤は限られています。TIL療法は、患者さん本人のがん組織に含まれるリンパ球と呼ばれる免疫細胞を採取して体外で大量に培養し、患者さんに戻す養子免疫療法の一種です。TIL療法の注目すべき特徴は、期待される高い奏効率に加え、TIL療法でいったんがんが消滅した場合、その後の再発は少なく、完治する可能性もあると報告されていることです。従来の治療が効かない患者さんに希望をもたらす治療法と言えます。しかし、この治療には、高度なTILの培養技術が必要なため、実施可能な施設は世界で約10施設程度にとどまります。慶應義塾大学では、このTILの培養技術を日本で唯一確立し、既に2016年に3例の悪性黒色腫患者にTIL療法を実施しています。今回、最大10名の進行子宮頸癌を対象として、TIL療法を実施します。
1.TIL療法の概要
| 〔研究課題名〕 | 進行子宮頸癌に対する骨髄非破壊的前処置および低用量IL-2を用いた短期培養抗腫瘍自己リンパ球輸注療法の第II相臨床試験 |
| 〔実施責任者〕 | 慶應義塾大学医学部産婦人科学教室 専任講師 岩田卓 |
| 〔実施機関〕 | 慶應義塾大学病院 |
<研究の背景>
腫瘍浸潤リンパ球輸注療法(TIL療法)は、患者さん本人のがん組織に含まれる腫瘍浸潤リンパ球(TIL)と呼ばれる免疫細胞を採取して体外で大量に培養し、患者さんにTILを戻す養子免疫療法の一種です。TIL療法は米国を中心に、主に進行悪性黒色腫に対して実施され、治療効果が報告されてきました。悪性黒色腫に対するTIL療法の成績は、腫瘍が縮小した患者(奏効率)が約7割で、病変が完全に消失する割合(完全奏効)は約2割とされ、さらに、完全奏効の患者では少数の例外を除き再発しないことが知られています(Clin. Cancer Res., 2011. 17, 4550–7 )。高い有効性が評価され、悪性黒色腫を対象としたTIL療法は2024年2月に米国食品医薬品局(FDA)によって認可されました。再発子宮頸癌でも9例の報告があり2例の完全奏効が報告され、この2例は5年以上再発していません(J Clin Oncol., 2015. 33: 1543-5)。
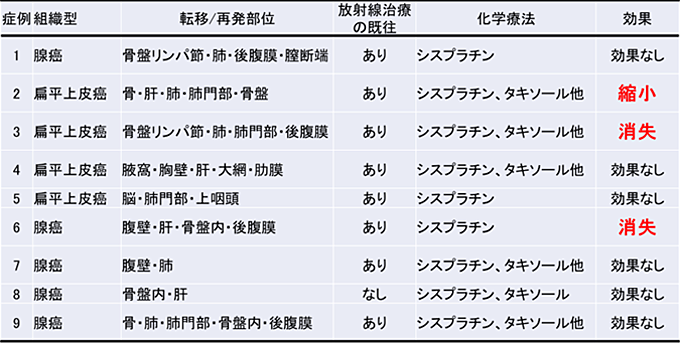
再発子宮頸癌9例に対するTIL療法の効果(米国NCI) J Clin Oncol., 2015. 33: 1543-5より作成
米国では子宮頸癌に対するTIL療法の企業治験も始まり、にわかに注目を集めています。米国Ionance社では27例の進行子宮頸癌にTIL療法を治験として実施し、完全奏功が3例(11.1%)、部分奏功が9例(33.3%)、縮小しないまでも腫瘍の増殖が停止した11人を含めると計23人(85.2%)に有効性が示されました(https://www.iovance.com/uploads/ASCO2019_Poster_C-145-04_cervical_FINAL.pdf)。このように、TIL療法は、従来の治療が期待できなかった患者さんにとって、大きな希望の炎をともす治療と言えます。しかしこの治療は、高度なTILの培養技術が必要なため、実施可能な施設は世界でも約10施設程度にとどまります。我々は、このTILの培養技術を日本で最初に確立し今回、最大10例の進行子宮頸癌を対象として、TIL療法を実施します。
<研究の概要>
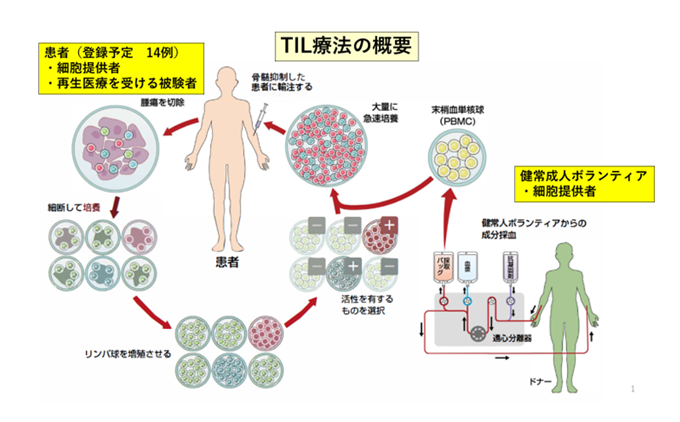
TIL療法では、患者さんは2度の入院が必要です。1度目の入院では、腫瘍浸潤リンパ球(TIL)を入手するための腫瘍切除術を行います。そして、細胞培養センターで、切除した腫瘍からTILを分離し、培養を開始します。最終的にTILを約100億以上に増殖させ、患者さんに投与します。なお、このTILの大量培養の過程では、リンパ球を増やすために他人の末梢血単核球(PBMC)が必要になります。今回の試験では1人の患者当たり3人のボランティアの方々からPMBCを提供いただき、TIL培養に使用します。
患者さんは手術から23週間後に2度目の入院をし、治療前の準備として、投与したTILが体内で増えやすい状態にするために、薬剤投与による骨髄抑制処置を行います。その後で、細胞培養センターから搬送したTILを患者さんに点滴投与し、さらにリンパ球を増やすIL-2を8時間ごとに最大5回、静脈投与します。患者さんの骨髄抑制が回復したことを確認し、投与後およそ10日程度で退院となります。投与後4週目と8週目で治療効果を判定します。
2.対象となる患者さん(適格基準と除外基準)
本試験の対象となる患者さんの主な適格基準は以下となります。
1)病理検査により子宮頸癌と診断されている方
2)標準的な抗がん剤治療(プラチナ製剤を含む化学療法)が無効であり、手術や放射線の適応がない方。なお、免疫チェックポイント阻害剤の投与の有無は問いません。
3)測定可能な病巣の他に、1~2週間程度の入院で切除可能な、TILを採取するための病巣(最低1cm以上)がある方
4)年齢が20歳以上であり、かつ65歳以下の方
5)本登録されてから3ヶ月以上の生存が期待される方
6)日常生活自立度が、①まったく問題なく活動できる。発症前と同じ日常生活が制限なく行える。または②肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる(例:軽い家事、事務作業)。のいずれかに該当する方
7) 骨髄、肝臓、腎臓などの機能が保たれている方
また、主な除外基準は以下となり、該当する方は試験に参加できません。
1)症状を伴う脳・脊髄への転移のある方
2)免疫抑制剤、副腎皮質ホルモンを内服している方
3)重い合併症(感染症、凝固異常、心疾患、呼吸器疾患、腎疾患、肝疾患、コントロール困難な糖尿病など)がある方
4)活動性の自己免疫疾患がある方
3.本臨床研究についてご理解いただきたいこと
この治療は、子宮頸癌患者さんに対してTIL療法を実施する我が国で最初の臨床研究です。そのため研究に参加される患者さんの安全性を最優先に行います。
4.費用について
本研究は先進医療として実施しています。先進医療の自費分は約608万円です。このほか、保険診療にかかわる費用が加算されます。
【用語解説】(注1)TIL (腫瘍浸潤リンパ球: Tumor Infiltrating Lymphocyte)】
腫瘍の中に浸潤するリンパ球の総称です。TILの中には、腫瘍を認識する、腫瘍抗原特異的リンパ球が多く存在することが知られています。
慶應義塾大学医学部 産婦人科学教室
専任講師 岩田 卓(いわた たかし)
TEL:03-5363-3819 / FAX:03-3226-1667 / E-mail:iwata.a8@keio.jp
http://www.obgy.med.keio.ac.jp/
なお、本試験の詳細は、jRCT(臨床研究実施計画・研究概要公開システム)で公開されています。計画番号はc031200283 です。